الأحماض والقواعد في الكيمياء

الأحماض والقواعد في الكيمياء من الأساسيات الهامة التي لابد من التعرف على الاختلاف بينهم وأهمية كل منهما واستخداماته في مجالات الحياة المختلفة، وأهم الخصائص التي يتميز بها كل منهما، حيث أن كل المحاليل التي تحتوي على ماء هي عبارة عن أحماض أو قواعد أو محلول متعادل منهما، وإليكم أبرز المعلومات حول هذا الموضوع.
الأحماض والقواعد في الكيمياء

جميع المحاليل الموجودة بالطبيعة يتم تصنيفها إلى ثلاث أنواع فقط لا غير، فقد تكون حامضية أو قاعدية أو متعادلة بشرط أن تحتوي على ماء، ولكن السوائل الأخرى التي لا تحتوي على ماء لا يتم خضوعها لهذا التصنيف.
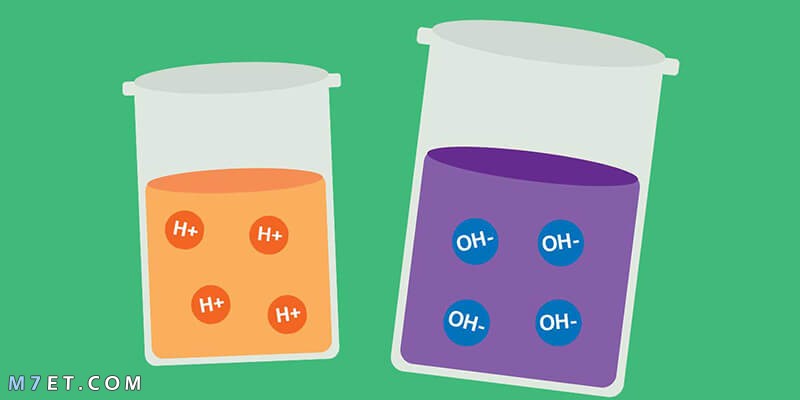
فتم تعريف الأحماض على أنها جميع الأجزاء التي تقوم باستقبال أو تفقد ذرة هيدروجين خلال التفاعل، بينما القواعد تفقد الإلكترونات وتكتسب ذرة هيدروجين خلال التفاعل،
ويتم تصنيفهم إلى أحماض وقواعد ضعيفة وقوية ويعتمد ذلك على قدرة كل مركب على تفككهم في الماء.
ويمكن قياس درجة حامضية أو قاعدية المحلول باستخدام الأس الهيدروجيني، والذي يتدرج من صفر إلى 14 فكلما اقتربت القيمة من الصفر زادت حامضية المحلول وقلت قاعديته والعكس، والقيمة 7 تدل على تعادل المحلول.
يحدث بين الحمض والقاعدة تفاعل تعادل ويتكون ماء وملح، وينتج محلول متعادل من هذا التفاعل، كما تختلف خصائص الأحماض عن القواعد كثيرًا ولا يوجد بينهما أي تشابه.
تعرف على: العناصر الكيميائية في جسم الإنسان
تعريف الأحماض والقواعد
يوجد الكثير من التعريفات الخاصة بالأحماض والقواعد، حيث قام كل عالم بتعريفهم بناءًا على أهم الخصائص التي تعرف عليها، وإليكم أهم التعريفات:
يعد العالم بويل أول قام بتصنيف وتعريف الأحماض والقواعد في الكيمياء بالاعتماد على بعض الخصائص، فالأحماض هو جميع المواد التي تتميز بطعمها الحامض وتحمر ورقة دوار الشمس وتؤدي إلى تآكل المعادن، بينما القواعد تزرق ورق دوار الشمس وملمسها زلق.
عرف ارهنيوس الأحماض على أنها جميع المركبات التي بها ذرة هيدروجين، وعند تفككها في الماء تنتج أيون هيدروجين، بينما القواعد مركبات تذوب في الماء وتنتج أيون الهيدروكسيد.
وجاء تعريف برونستد لوري كالتالي: الأحماض هي المادة التي يمكنها أن تفقد أيون هيدروجين، والقواعد هي المركبات التي يمكنها استقبال أيون ذرة الهيدروجين وهو ما يختلف عن تعريف ارهنيوس.
وقام العالم لويس بتعريف الأحماض والقواعد باستخدام زوج الإلكترونات الحر، فالحمض من وجهة نظره هي المادة التي تستقبل أزواج من الإلكترونات، بينما القاعدة تقوم بمنح هذه الأزواج.
لا يفوتك معرفة: خصائص الأحماض والقواعد
رموز الأحماض والقواعد
يوجد العديد من الأحماض والقواعد في الكيمياء والتي تختلف بين القوية والضعيفة ومن الصعب حصرها مرة واحدة، وإليكم رموز لأقوى الأحماض والقواعد ومنها:
- الهيدروكلوريك HCl
- الكبريتيك H2SO4
- النيتريك HNO3
- الفوسفوريك H3PO4
- الهيدروبروميك HBr
- البيركلوريك HClO4
- الهيدرويوديك HI
ومن القواعد القوية ما يأتي:
- هيدروكسيد الليثيوم LiOH
- هيدروكسيد الصوديوم NaOH
- هيدروكسيد البوتاسيوم KOH
- هيدروكسيد الباريوم Ba (OH)2
- هيدروكسيد الكالسيوم CaOH
- هيدروكسيد الروديوم RbOH
قد يهمك أيضًا: ما هي الخواص الفيزيائية للمواد بالتفصيل
استخدامات الأحماض والقواعد
إن عدد كبير من القواعد والأحماض يتم استخدامهم في مجالات عديدة في الحياة، وإليكم أهم استخدامات الأحماض كالتالي:
- حمض الكبريتيك: يدخل في صناعة البطاريات.
- الخل الذي نستخدمه في المنزل لحفظ الأغذية هو عبارة عن محلول مخفف من حمض الأسيتيك.
- حمض الستريك من المكونات الأساسية الموجودة في عصير البرتقال والليمون، ونستخدمه لحفظ الطعام.
- ويدخل في صناعة الأصباغ والمتفجرات والأسمدة والدهانات حمض النيتريك والكبريتيك.
- بينما حمض الفسفوريك من العناصر الأساسية التي توجد في المشروبات الغازية.
- ويتم استخدام حمض الهيدروكلوريك في عدة مجالات أهمها صناعة الصلب والتنظيف.
تدخل القواعد في الكثير من الاستخدامات أهمها:
- هيدروكسيد الماغنيسيوم هو مضاد قوي للحموضة وملين للأمعاء، ويطلق عليه أيضًا اسم حليب المغنيسيا.
- يتم استخدام هيدروكسيد الصوديوم في صناعة الورق والصابون والحرير الصناعي.
- بينما هيدروكسيد الأمونيوم هو أحد الكواشف الهامة والتي يتم استخدامها داخل المختبرات.
- وهيدروكسيد الكالسيوم في صناعة الدهانات وفي عملية البناء، ولمعادلة حموضة التربة وصناعة مساحيق التبييض، ويطلق عليه اسم الجير المطفأ.
شاهد أيضًا: أهمية علم الكيمياء | وابرز فروع علم الكيمياء
أمثلة على القواعد في المنزل
تدخل القواعد في العديد من الصناعات لذلك فمن السهل وجودها في أمثلة كثيرة من المواد التي نستخدمها داخل المنزل باستمرار ومنها:
- الكلور التي نستخدمه لصناعة الملابس هو عبارة عن مادة قاعدية تعادل حمض الهيدروكلوريك.
- الشاي والقهوة يحتويان على مادة الكافيين وهي مادة قاعدية، كما تحتوي أوراق الشاي على تركيز عالي منه، وأيضًا مادة البيورين وهو عبارة عن قاعدة نيتروجينية.
- الشوكولاتة تحتوي على القهوة بالإضافة إلى احتوائها على مادة الثيوبرومين وهو قاعدة نيتروجينية وهو الذي يعطي المزاج المميز للشوكولاتة.
- الصابون وهو عبارة عن أحماض دهنية وهيدروكسيد الصوديوم ويوجد داخل كل منزل ولا يمكن الاستغناء عنه.
- مزيلات الروائح وهي عبارة عن هيدروكسيد الألومنيوم وهو عبارة عن مادة نشطة تستخدم لإزالة العرق ومبيد للجراثيم، وتساعد في التخلص من الجراثيم التي تتغذى من الدهون والبروتينات الموجودة بالعرق.
- مضادات الحموضة عبارة عن قواعد ضعيفة ومركبات البيكربونات النشطة، وحليب المغنيسيا هو ملين للأمعاء ومضاد للحموضة أيضًا.
- التبييض وهو هيدروكسيد الصوديوم الذي يعد من أقوى القواعد الموجودة والمكون الأساسي لمنظفات التصريف.
ننصحك بقراءة: الخواص الكيميائية للمادة
وبذلك نكون قد وضحنا لكم الكثير من المعلومات حول الأحماض والقواعد في الكيمياء وأهم استخداماتهم وأمثلة على الأحماض والقواعد القوية،
بالإضافة إلى أهم الأمثلة على القواعد في المنزل، ويجب التنويه على وجود العديد من الطرق لمعرفة درجة حموضة أو قاعدية الحمض غير الأس الهيدروجيني.